Si vous avez été formé·e en hôpital après le déclenchement de votre diabète de type 1 ou de celui de votre enfant, vous avez sûrement appris que l’insuline permet de faire baisser la glycémie en faisant entrer le glucose dans nos cellules.
Mais on ne sait pas forcément comment ça marche, ni d’ailleurs que l’insuline agit de bien d’autres façons sur la régulation de notre glycémie.
Pourtant, c’est en connaissant le diabète sur le bout des doigts qu’on est le plus à même de contrôler nos glycémies!
Dès lors, il est crucial de comprendre comment l’insuline, l’hormone au coeur du diabète de type 1, agit très exactement.
Cet article laisse volontairement de côté les effets indirects et de long terme de l’insuline sur la glycémie, les autres fonctions de l’insuline, comme par exemple son rôle dans le métabolisme des lipides, et l’action d’autres hormones qui impactent la glycémie, comme le glucagon.
Car en se concentrant uniquement sur les effets directs et immédiats de l’insuline sur notre glycémie…il y a déjà beaucoup à dire!
Insuline et transport du glucose via les GLUT
Le rôle de l’insuline que nous connaissons le mieux, c’est celui de permettre de faire entrer le glucose dans nos cellules pour qu’elles puissent l’utiliser pour leurs besoins énergétiques.
C’est d’ailleurs le rôle qui a longtemps été le plus étudié et donc le mieux connu.
Voyons donc comment l’insuline permet l’entrée du glucose dans nos cellules, mais aussi pourquoi le glucose n’a pas toujours besoin d’insuline pour y entrer!
Traverser les membranes cellulaires: mode d’emploi
Chacune de nos cellules est entourée d’une membrane, qui sépare l’intérieur de la cellule de son environnement extérieur.
On l’appelle membrane plasmique, membrane cellulaire, ou encore membrane cytoplasmique.
Pour permettre le bon fonctionnement de nos cellules, nos membranes fonctionnent un peu comme la peau à l’échelle de l’organisme: elles maintiennent certains éléments à l’intérieur ou à l’extérieur de la cellule, et permettent à d’autres d’entrer et/ou de sortir de la cellule.

Le dioxygène, le diazote ou encore l’éthanol par exemple, peuvent traverser les membranes plasmiques seuls et sans apport d’énergie, par un phénomène appelé diffusion simple.
D’autres éléments comme l’eau, les acides aminés, ou certains ions, n’ont pas besoin d’un apport d’énergie pour entrer ou sortir de nos cellules, mais elles ont besoin d’une sorte de facilitateur.
On parle alors de transport passif, et ce facilitateur peut être un canal (appelé canal ionique ou port), ou une protéine de transport membranaire (appelée transporteur ou perméase).
D’autres encore nécessitent un facilitateur et un apport d’énergie. On parle alors de transport actif.

Mode de transport membranaires du glucose: SGLT et GLUT
Le glucose, quant à lui, ne peut pas entrer ou sortir d’une cellule par diffusion simple.
Il peut faire cette navette par transport actif via les protéines de transport SGLT1 et SGLT2 (Sodium-Glucose Linked Transporter), identifiées en 1960, et particulièrement intéressantes dans le traitement du Diabète de Type 2.
Le glucose utilise également le transport passif, à l’aide de protéines de transport.
Parmi ces protéines, on trouve les GLUT (pour GLUcose Transporter), dont on connaît aujourd’hui 14 types.
GLUT1, le premier à avoir été découvert à la fin des années 1970, et GLUT3, par exemple, sont présents dans presque toutes nos cellules, dont le cerveau, la rétine, les reins, les globules rouges, le placenta.
Les GLUT2 peuvent transporter du glucose, mais aussi d’autres types de glucides comme le fructose ou le galactose (notamment présent dans le lait), et sont très présents dans nos hépatocytes (cellules du foie), notre épithélium intestinal, notre hypothalamus et nos cellules bêta-pancréatiques.
GLUT1, GLUT2 et GLUT3 sont insulino-indépendants, comme la plupart des GLUT. C’est-à-dire qu’ils ne dépendent pas de la présence d’insuline pour transporter le glucose à travers les membranes cellulaires.
Ainsi, c’est la présence de nombreux GLUT1 et GLUT3 dans notre cerveau qui explique pourquoi le cerveau n’a pas besoin d’insuline pour se procurer du glucose, puisque ces transporteurs assurent le passage du glucose du sang vers l’intérieur de ces cellules sans l’intermédiaire d’insuline.
De la même façon, le glucose n’a pas besoin d’insuline pour entrer dans les cellules bêta pancréatiques grâce à la présence de GLUT2 dans ces cellules.
Ainsi, grâce aux GLUT2, chez une personne non-diabétique, le pancréas peut détecter une augmentation de la concentration de glucose et réagir en activant la libération de l’insuline qui y est stockée.
Mais alors, pourquoi l’insuline est-elle aussi cruciale dans la régulation de la glycémie à l’échelle de l’organisme?
Insuline et transporteur GLUT4
Le glucose a beau pouvoir entrer dans de nombreuses cellules sans l’intermédiaire de l’insuline, l’homéostasie glycémique est malgré tout impossible à maintenir sans insuline.
L’homéostasie est un ensemble de phénomènes grâce auxquels un facteur clé est maintenu autour d’une valeur bénéfique pour le système considéré, grâce à un processus de régulation.
Pourtant, l’insuline ne crée pas ni ne détruit de glucose à proprement parler. Puisque c’est une hormone, son rôle est simplement d’envoyer des signaux, de transmettre des messages, qui déclenchent des chaînes de réactions.
Une hormone est une substance produite naturellement par un organe du corps, qui est transportée par le sang et agit sur d’autres organes. C’est une substance chimique biologiquement active, synthétisée par une cellule glandulaire et sécrétée dans le milieu intérieur où elle circule, agissant à distance et par voie sanguine sur des récepteurs spécifiques d’une cellule cible. Elle transmet un message sous forme chimique et joue donc un rôle de messager dans l’organisme.
Wikipedia
L’une des raisons est qu’un autre transporteur de glucose, GLUT4, s’active et agit principalement au contact de l’insuline (mais aussi lors d’une activité sportive).
En l’absence d’insuline et d’activité sportive, 90% des GLUT4 sont en quelque sorte rangés dans des vésicules localisées à l’intérieur des cellules .
Mais lorsque la concentration d’insuline dans le sang augmente à proximité des cellules, les GLUT4 au repos s’activent et se déplacent vers la membrane plasmique, attirés comme des aimants par l’insuline.
Lorsqu’un GLUT4 atteint la membrane plasmique, il fusionne avec cette dernière, créant une sorte de pont permettant l’entrée du glucose dans la cellule.
![Déplacement transporteurs glut 4 en présence d'insuline · GLUT4 · Source: CNX OpenStax [CC BY 4.0 (https://creativecommons.org/licenses/by/4.0)], Wikimedia Commons.](https://happy-diabetes.com/wp-content/uploads/2022/01/Déplacement-transporteurs-glut-4-en-présence-dinsuline-300x203.jpeg)
Deux types de cellules, nombreuses à l’échelle de l’organisme et intimement liées à la consommation et au stockage de l’énergie, ne sont pas équipées de GLUT1, 2, et 3, mais plutôt de nombreux GLUT4: les cellules adipeuses (masse grasse) et celles des muscles striés squelettiques (muscles).
De par leur forte concentration en GLUT4, ce sont ainsi les cellules musculaires et adipeuses qui sont majoritairement responsables de l’absorption du glucose sanguin en réponse à l’insuline.
Ainsi, en présence d’une forte concentration d’insuline dans la circulation sanguine aux abords de ces cellules, le volume de glucose dans la cellule musculaire ou adipeuse augmentera, et le taux de glucose sanguin diminue.
Voici donc un premier mode d’action de l’insuline.
Voyons maintenant quelles sont ses autres fonctions-clés sur la régulation de la glycémie.
Formation, stockage et déstockage des substrats énergétiques
L’insuline joue également un rôle clé dans la régulation des mécanismes de stockage et de déstockage de nos « substrats énergétiques« , les matières premières que nos cellules utilisent pour produire de l’énergie.
Parmi ceux-ci, on trouve bien évidemment le glucose!
Devenir des glucides après digestion
Lorsque nous ingérons des glucides, à l’exception des fibres alimentaires, notre processus de digestion les découpe en petites unités: les molécules de glucose.
Elles quittent ensuite notre intestin pour rejoindre la veine porte hépatique, qui les amène jusqu’au foie.

À son arrivée dans le foie, chaque molécule de glucose aura l’un de ces 4 destins:
· elle poursuivra son chemin vers le reste de la circulation sanguine
· elle sera phosphorylée pour être transformée en glucose-6-phosphate, autrement dit « activée », par une enzyme appelée glucokinase, propre au foie. Dès lors, elle ne peut plus quitter la cellule hépatique en l’état et suivra l’une de ces 3 voies métaboliques à l’intérieur du foie:
- elle viendra grossir les rangs du glycogène hépatique jusqu’à atteinte d’un volume optimal
- elle entrera dans la voie des pentoses phosphates, permettant le bon fonctionnement de la cellule, que nous ne détaillerons pas ici
- elle subira une glycolyse, c’est-à-dire qu’elle sera transformée en pyruvate, qui joue de nombreux rôles dans notre organisme et dont nous parlerons plus bas
Insuline et formation du glycogène
Notre organisme n’a que rarement besoin d’utiliser l’intégralité du glucose issu des glucides ingérés lors d’un repas pour son fonctionnement immédiat.
Mais nous devons garder précieusement en réserve, autrement dit stocker, le glucose excédentaire ingéré lors des repas, car nous en aurons besoin à distance des repas.
Ce glucose pourra ainsi être transformé en lipides et s’ajouter à notre tissu adipeux, ou rester du glucose, et être stocké dans notre glycogène.
Le glycogène est ainsi la principale forme de stockage d’énergie sous forme de glucose chez l’homme.
Il ressemble en quelque sorte à un collier de perles avec des ramifications à intervalles réguliers, où chaque perle est une molécule de glucose.
Le glycogène est donc un polymère du glucose, c’est-à-dire qu’il est composé d’une succession d’unités de cette seule molécule.

L’ajout de molécules de glucose au glycogène existant est appelé glycogénogénèse, pour génèse (ou création, ou encore synthèse) de glycogène.
La chaîne de réactions qui mène à la glycogénogénèse est catalysée (déclenchée) par une enzyme, la glycogénèse synthase, que l’insuline active (on dit qu’elle la déphosphoryle).
Une enzyme est une protéine qui a un rôle de catalyseur biologique, c’est-à-dire qu’elle accélère les réactions biochimiques de l’organisme.
Ces réactions peuvent être schématisées comme suit:

En plus de favoriser la captation du glucose sanguin par nos cellules musculaires et adipeuses pour leurs besoins métaboliques en activant leurs transporteurs GLUT4, l’insuline active donc l’enzyme qui permet la glycogénogénèse hépatique: elle incite le foie à capter le glucose, cette fois principalement pour le stocker sous forme de glycogène.
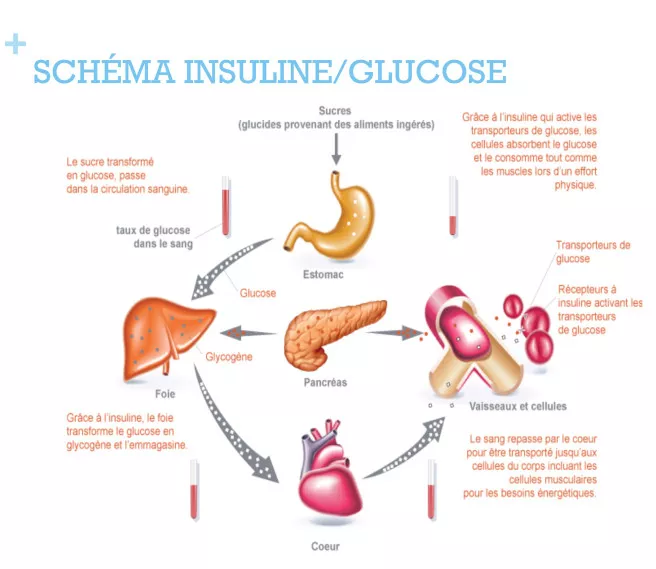
Insuline et libération du glucose depuis le glycogène
Le glycogène présente l’avantage de pouvoir rapidement fournir du glucose à notre organisme à distance des repas.
La mise à disposition rapide du glucose depuis le glycogène est possible pour deux raisons:
- il ne faut pas transformer « quelque chose » pour obtenir du glucose comme dans le cas de la néoglucogénèse, puisque c’est précisément du glucose qui y est stocké
- la forme en collier de perles du glycogène est idéale: pour mobiliser rapidement le glucose, il suffit de « découper » le nombre de « perles » (les molécules de glucose) souhaitées, disponibles depuis l’une des extrémités, ou ramifications, du collier (le glycogène)

Le découpage du glycogène pour libérer le glucose qui y est stocké, c’est la glycogénolyse: la –lyse, ou dissolution, du glycogène, et c’est une enzyme, la glycogène phosphorylase, qui joue le rôle de paire de ciseaux.
L’activité de cette enzyme clé de la glycogénolyse est régulée par des hormones:
- elle est activée par des hormones dites hyperglycémiantes comme le glucagon au niveau du foie, ou l’adrénaline au niveau des muscles
- à l’inverse, elle est inactivée par l’hormone hypoglycémiante que nous connaissons bien: l’insuline
C’est en fait le ratio insuline/glucagon présent dans nos cellules hépatiques qui favorise la glycogénolyse ou la glycogénogénèse hépatiques.
Lorsque la concentration en insuline par rapport au glucagon augmente, davantage de glucose est transformé en glycogène hépatique, et lorsque c’est le glucagon qui prend le pas sur l’insuline, du glucose est libéré depuis le glycogène hépatique vers la circulation sanguine.
Car tout comme on ne peut pas inspirer et expirer en même temps, la glycogénolyse et la glycogénogénèse empruntent les mêmes voies, mais dans deux sens opposés. Elles ne peuvent donc pas avoir lieu simultanément au sein d’une même cellule.

C’est pour cela qu’on dit que le glucagon et l’insuline ont des rôles antagonistes, ou opposés, même si en réalité, les choses ne sont pas si simples.
À ce stade, nous savons donc que l’insuline a un effet hypoglycémiant ou hyperglycémiant direct via:
- la captation ou non du glucose sanguin par les muscles et le tissu adipeux
- l’activation ou non du stockage du glucose dans le glycogène musculaire et hépatique
- la libération dans la circulation sanguine ou non du glucose contenu dans le glycogène hépatique
Mais qu’en est-il pour le glycogène musculaire?
Glycogène hépatique et glycogène musculaire
Comme nous l’avons vu, lorsqu’un afflux de glucose arrive au foie après digestion des glucides alimentaires, une partie de ce glucose est gardée et utilisée par le foie, et une partie rejoint la circulation sanguine.
Nos cellules musculaires en mettront une partie en réserve, car elles possèdent elles aussi leur propre stock de glucose sous la forme de glycogène.
C’est en fait le cas de nombreuses cellules, comme les globules rouges, des cellules nerveuses, ou encore des cellules de l’épithélium vaginal.
Mais ces réserves sont infimes et ne leur permettent de fonctionner que durant quelques minutes voire quelques heures.
En fait, nos réserves de glycogène sont quasi intégralement concentrées dans deux types de cellules: nos cellules musculaires et nos cellules hépatiques.
Nos cellules musculaires disposent de 3/4 du stock de glycogène à l’échelle de l’organisme, de l’ordre de 300g.
Le foie, quant à lui, contient en moyenne 100g de glycogène, soit 1/4 des réserves totales de notre organisme.
En termes de proportions, 300g de glycogène pour 20Kgs de muscles en moyenne contre 100g de glycogène pour 1,5Kg de foie, cela revient à 66g / Kg de foie, bien plus que les besoins journaliers du foie en glucose, contre 15g / Kg de muscle, qui sont pourtant de gros consommateurs de glucose!
Sans parler de notre cerveau, qui ne fonctionne quasiment que grâce au glucose, en utilise environ 120g par jour, et n’a pourtant presque aucune réserve.
Plus étrange encore, les réserves de glycogène contenues dans nos muscles, donc 3/4 de nos réserves totales…ne peuvent plus être libérées dans la circulation sanguine pour êtres distribuées à d’autres cellules une fois qu’elles sont entrées dans les cellules musculaires!
En fait, seul le foie est capable de libérer du glucose depuis ses propres réserves de glycogène pour le libérer dans la circulation sanguine.

C’est notre foie qui sert de véritable banque de glucose à distance des repas, et c’est lui qui est en charge de rythmer la distribution du glucose au reste de l’organisme, aiguillé par les signaux transmis par l’insuline et le glucagon.
On dit que les réserves de glucose du glycogène hépatique sont « publiques », alors que le glycogène musculaire forme des réserves dites « privées« .
Ainsi, dans nos muscles, lorsque le ratio insuline/adrénaline (qui joue ici le rôle du glucagon dans le foie) est bas et donc favorable à la libération du glucose contenu dans le glycogène musculaire, cela ne libère pas de glucose dans le sang, mais simplement à l’intérieur de la cellule.
C’est pour cela qu’à l’inverse du glycogène hépatique, le rôle hypoglycémiant de l’insuline via l’inhibition de la glycogénolyse musculaire n’est pas direct.

NB: Nos reins et nos intestins disposent également de réserves publiques de glycogène, mais dans une moindre mesure, et le glycogène rénal est principalement sollicité en cas de jeûne prolongé.
Insuline et Néoglucogénèse
Nous voici arrivés au dernier impact direct de l’insuline sur la glycémie.
La néoglucogénèse est le processus de fabrication de glucose à partir de précurseurs non-glucidiques, c’est-à-dire, qui ne sont ni le glucose directement issu de la digestion des glucides après un repas, ni celui mis en réserve dans le glycogène puis libéré par glycogénolyse.
On parle de néoglucogénèse puisqu’on synthétise, on produit (génèse) du « nouveau » (néo) glucose (gluco), ou encore de gluconéogenèse, ou synthèse de glucose de novo.
Mais avec tous nos stocks de glycogène, pourquoi a-t-on besoin de pouvoir produire encore plus de glucose?
Voyons deux cas d’usage de la néoglucogénèse, pour comprendre ce dernier mode d’action direct de l’insuline sur la glycémie.
Activité musculaire, lactate et néoglucogénèse
Prenons pour commencer l’exemple de la libération d’énergie à partir de glucose dans les cellules de nos muscles striés squelettiques, ou, pour faire simple, nos muscles.
Lorsqu’une molécule de glucose entre dans une cellule musculaire, elle servira à former de l’ATP*, qui lui-même libèrera de l’énergie.
*Qu’est-ce que l’ATP?
L’ATP est le sigle de l’Adénosine TriPhosphate. TRIphosphate, car cette molécule comprend 3 phosphates.
Chez TOUS les êtres vivants, cette molécule fournit l’énergie nécessaire aux réactions chimiques du métabolisme, à la locomotion, à la division cellulaire, ou encore au transport actif d’espèces chimiques à travers les membranes biologiques .
Ce n’est pas une molécule qui permet le stockage de l’énergie, mais plutôt une molécule de transfert énergétique: elle apporte l’énergie là où elle est nécessaire. On peut dire que c’est la forme « matérielle » la plus proche de l’énergie dans notre organisme.
En effet, le processus de libération d’énergie chez les être vivants s’effectue d’une seule et unique manière: l’hydrolyse de l’ATP.
L’hydrolyse de l’ATP, c’est lorsqu’une des 3 molécules de phosphate contenues dans l’ATP se sépare de l’ATP, qui devient alors de l’ADP, pour Adénosine DiPhosphate (di = deux phosphates).
C’est au cours du clivage entre l’ATP et l’un de ses 3 phosphates que de l’énergie est libérée.
Si les réserves d’énergie ne sont pas stockées sous forme d’ATP alors que cela permettrait de pouvoir générer immédiatement de l’énergie, c’est parce que l’ATP a un moins bon rapport « poids/énergie utilisable » que le glycogène ou même les graisses.
Ainsi, nous avons en moyenne 76 grammes d’ATP en permanence dans l’organisme, soit l’équivalent d’environ 1,2 calories…ou quelques secondes d’effort, mais 500g de glucose sous forme de glycogène, soit 2000 calories, sans oublier une bonne dizaine de kilos lipides, donc plus de 100 000 calories!
Un bel exemple de l’incroyable « intelligence » du vivant, vous ne trouvez pas?
La première étape du devenir glucose dans nos cellules musculaires, c’est sa transformation en pyruvate, un complexe enzymatique clé dans notre métabolisme énergétique.
Ensuite, la façon dont le pyruvate formera de l’ATP dépend de plusieurs facteurs, notamment le pH, l’activité enzymatique de la cellule, ses besoins en ATP, et la présence ou non d’oxygène et d’autres composés.
Pour les besoin d’une cellule musculaire « au repos », le pyruvate peut entrer dans la mitochondrie de la cellule pour être transformé en Acétyl-coA, qui fournira de l’énergie via le cycle de Krebs, ou cycle de l’acide citrique.
C’est une voie relativement longue et donc lente.
Mais, et c’est un « mais » d’importance, la dégradation du pyruvate est complète: à la fin du cycle de Krebs, l’Acétyl-CoA est devenu de l’oxaloacétate, qui n’est autre que le substrat, ou matière première, pour démarrer le prochain cycle.
Au final, les produits de cette réaction sont soit recyclés via la respiration cellulaire, soit, pour l’H2O (eau) et le Co2 (dioxyde de carbone), facilement expulsés hors de la cellule puis de notre organisme ou réutilisés, et aucun déchet organique n’est produit puisque l’oxaloacétate est réutilisé pour démarrer le prochain cycle.
Ce qu’on peut retenir, c’est que le cycle de Krebs une façon « écologique » de créer de l’énergie, en quelque sorte!
Mais souvenons-nous que cette réaction ne peut se produire qu’avec l’apport d’oxygène, ou plutôt de dioxygène, et qu’elle est longue et lente.
Et lors d’efforts courts et intense, les cellules musculaires sollicitées ont besoin de fournir beaucoup d’énergie rapidement.
Rapidement, c’est-à-dire avant que notre rythme respiratoire n’ait eu le temps de s’accélérer pour lui fournir davantage d’oxygène, et plus rapidement que ce que ne permet le cycle de Krebs.
Dans ce cas, nos cellules musculaires doivent produire de l’ATP en anaérobie (an- = « sans », aérobie = « en présence d’oxygène ») dans leur cytosol.
C’est alors qu’elles utilisent une voie différente du Cycle de Krebs: la fermentation.
Chez les animaux et donc chez l’homme, c’est une fermentation lactique, car l’utilisation du glucose, ou plutôt de pyruvate, pour fournir de l’ATP via la fermentation dans le cytosol produit du lactate, ou acide lactique.
On peut noter que chez les levures, cette réaction de fermentation produit de l’éthanol (de l’alcool) et non du lactate. C’est donc une fermentation alcoolique, inexistante chez les humains.
Mais à l’inverse de l’oxaloacétate formé par le cycle de Krebs qui permet de lancer un nouveau cycle de création d’ATP à partir de pyruvate, le lactate produit par fermentation du pyruvate ne peut pas être utilisé par nos muscles striés squelettiques pour fournir de nouveau de l’ATP.
Pour résumer, la fermentation lactique permet de fournir quasi instantanément de l’énergie à nos muscles striés squelettiques en cas d’effort court et intense, mais elle produira une molécule organique, le lactate, inutilisable par la cellule dans laquelle il se trouve.
Mais alors que devient le lactate produit par ce processus de fermentation?
C’est là que la néoglucogénèse entre en jeu.
Car le lactate ainsi produit peut rejoindre le foie, qui pourra soit l’éliminer via les urines, soit le transformer en pyruvate, puis en glucose…qui pourra à son tour être acheminé dans la circulation sanguine puis être utilisé par les muscles ou d’autres cellules, faisant au passage augmenter notre glycémie!
Ce cycle est appelé cycle de Cori, et l’étape de transformation du lactate en pyruvate puis en glucose dans le foie est un exemple de néoglucogénèse:
C’est un moyen très malin de réutiliser les produits du métabolisme énergétique de nos cellules musculaires, car de nombreuses cellules utilisent la fermentation lactique.
C’est par exemple le cas des globules rouges, puisqu’ils sont dépourvus de mitochondries et ne peuvent donc pas utiliser le cycle de Krebs pour former leur ATP.
Mais, ce n’est pas le seul cas dans lequel la néoglucogénèse se produit: elle est également liée au métabolisme des lipides.
Métabolisme des lipides, glycérol et néoglucogénèse
Nos réserves d’énergie sous forme de lipides, les acides gras, sont stockées dans des cellules appelées adipocytes, les principaux constituants du tissu adipeux, notre « matière grasse ».
Le stockage des lipides est la fonction premières des adipocytes. Ainsi, lorsqu’elles sont utilisées à leur plein potentiel, elles sont gorgées de triglycérides, formées de glycérol et d’acides gras.
Car les acides gras peuvent circuler sous forme libre lorsqu’ils sont en transit dans la circulation sanguine vers un lieu d’utilisation, mais lorsqu’ils doivent être stabilisés pour être stockés, ils sont associés à trois molécules de glycérol, d’où le terme de triglycérides.
Lorsque notre corps a besoin de mobiliser les réserves en acides gras contenues dans les triglycérides de notre tissu adipeux, les acides gras et le glycérol devront être séparés pour que les acides gras, désormais libres, puissent alimenter d’autres cellules.
Une enzyme appelée lipase catalyse cette réaction. L’insuline agit également sur l’activation ou l’inactivation de cette enzyme, mais nous verrons cela plus en détail dans un autre article.
Le glycérol, quant à lui, pourra rejoindre le foie (encore lui!), capable de faire subir au glycérol des transformations qui lui permettront de rejoindre un cycle de glycolyse….ou de néoglucogénèse!
Du « nouveau » glucose pourra ainsi être formé et libéré dans la circulation sanguine par néoglucogénèse à partir du glycérol, faisant augmenter la glycémie.
La néoglucogénèse à partir de glycérol et de lactate permet ainsi d’utiliser des ressources disponibles pour libérer du glucose dans la circulation sanguine et alimenter notre corps en « énergie ».
La néoglucogénèse utilise également d’autres substrats, et nos reins sont également capable de néoglucogénèse, mais nous ne détaillerons pas ces réactions dans cet article.
La néoglucogénèse est donc favorisée en période de jeûne plus ou moins prolongé, et ralentie en période post-prandiale.
Et tout comme pour la glycogénèse et la glycogénolyse, le rythme de la néoglucogénèse est dicté par la concentration relative des hormones qui la régulent, en particulier le glucagon, qui l’accélère, et l’insuline, qui la ralentit.
Ces hormones ne font que ralentir ou accélérer la néoglucogénèse, mais ne la stoppent pas.
La néoglucogénèse a en fait lieu en permanence dans notre organisme, à un rythme de croisière, un rythme basal, qui contribue largement à alimenter nos cellules gluco-dépendantes à distance des repas, et donc pendant la nuit, avec l’aide de la glycogénolyse hépatique.
Et si le mot basal fait écho au débit basal des pompes à insuline pour certains, et à l’insuline lente pour d’autres, ce n’est pas un hasard.
Car l’un des rôles majeurs de notre insuline lente, c’est justement de maintenir le ratio glucagon/insuline à son niveau basal pour réguler la néoglucogénèse et la glycogénolyse: sans cette insuline, le ratio serait très favorable au glucagon, et la néoglucogénèse et la glycogénolyse fonctionneraient à rythme soutenu la nuit, provoquant de fortes hyperglycémies.
C’est d’ailleurs ce qui se produit lors de l’oubli d’une injection d’insuline lente ou lorsqu’une pompe cesse de fonctionner!
CONCLUSION
Nous savons maintenant que l’insuline n’agit pas uniquement en augmentant le volume de glucose qui entre dans les cellules insulino-dépendantes.
En résumé, l’insuline agit bien directement sur l’homéostasie glucidique à 4 niveaux, via:
- la captation ou non du glucose sanguin par les muscles et le tissu adipeux
- l’activation ou non du stockage du glucose dans le glycogène musculaire et hépatique
- la libération dans la circulation sanguine ou non du glucose contenu dans le glycogène hépatique
- le freinage ou l’accélération de la néoglucogénèse
L’insuline impacte également le tissu adipeux, comme montré sur le schéma récapitulatif ci-dessous, et sur lequel nous nous pencherons plus en détails dans un prochain article.

Pour mieux comprendre comment la glycémie est régulée, nous nous pencherons aussi sur les autres hormones qui régulent la glycémie, comme le glucagon, l’adrénaline ou encore l’hormone de croissance.
Nous verrons également comment l’insuline et le diabète de type 1 impactent le métabolisme des lipides et les variations de poids, mais aussi le métabolisme des protéines en lien avec la masse musculaire, sans oublier d’autres dynamiques clés comme la cétogénèse, l’acidocétose et la glycolyse.
Si vous avez aimé cet article et que vous souhaitez être averti·e des prochains articles et contenus Happy Diabetes, rendez-vous dans la newsletter Happy Diabetes (https://happy-diabetes.com/newsletter) sur Instagram (@happy_diabetes_type_1) ou Facebook (page Happy Diabetes)!

SOURCES PRINCIPALES
Transporteurs: Le Transport Passif : diffusion simple, diffusion facilitée et l’osmose · https://www.youtube.com/watch?v=Lk1Jnjt9ckE
GLUT · https://biochimej.univ-angers.fr/Page2/COURS/3CoursdeBiochSTRUCT/7Transports/1Transports.htm
GLUT4 et Diabète de type 2 · https://www.medecinesciences.org/en/articles/medsci/full_html/2010/02/medsci2010261p33/medsci2010261p33.html
Voie de transduction du signal de l’insuline Voie de transduction du signal de l’insuline · https://fr.abcdef.wiki/wiki/Insulin_signal_transduction_pathway
Lactate : le substrat énergétique de demain J.-C. Orbana, X. Leverve, C. Ichai · https://www.srlf.org/wp-content/uploads/2015/11/1009-Reanimation-Vol19-N5-p384_392.pdf
Le foie, un organe extraordinaire · https://badgut.org/centre-information/sujets-de-a-a-z/le-foie-un-organe-extraordinaire/?lang=fr
Les principales voies du métabolisme · https://bionet.scenari-community.org/res/voies_metabolisme.pdf
Métabolisme des glucides · https://www.cours-pharmacie.com/biochimie/metabolisme-des-glucides.html
Des protéines actives dans la régulation de la glycémie · http://acces.ens-lyon.fr/biotic/gpe/dossiers/glycogene/html/synthese.htm
Régulation de la glycémie · https://fr.abcdef.wiki/wiki/Blood_sugar_regulation
Glycogène · https://www.aquaportail.com/definition-796-glycogene.html
Glycogène · https://nutrixeal-info.fr/index/glycogene-polymere-glucose-energie-chimique-foie-muscles/
Métabolisme du glycogène, répartition des réserves de glycogène hépatiques et musculaires · http://www.nutritionnistes.be/bases%20de%20la%20nutrition%20glucides%203.htm




